读医学网
干细胞移植耐药巨细胞病毒感染的治疗(上)
发布时间:2017-03-01 09:26 类别:医学前沿资讯 标签:耐药 干细胞 来源:未知
免疫系统功能正常个体发生巨细胞病毒(CMV)感染普遍且多无症状,但癌症患者细胞免疫功能下降时,特别是造血干细胞移植(HCT)患者罹患CMV感染时出现明显并发症。目前常用有效药物包括更昔洛韦、缬更昔洛韦、膦甲酸和西多福韦。美国Chaer教授在BLOOD杂志上以2例HCT后复发难治CMV感染为例,详细描述了CMV感染的治疗。
免疫系统功能正常个体发生巨细胞病毒(CMV)感染普遍且多无症状,但癌症患者细胞免疫功能下降时,特别是造血干细胞移植(HCT)患者罹患CMV感染时出现明显并发症。目前常用有效药物包括更昔洛韦、缬更昔洛韦、膦甲酸和西多福韦。美国Chaer教授在BLOOD杂志上以2例HCT后复发难治CMV感染为例,详细描述了CMV感染的治疗。 【病例资料】 病例1 55岁男性,急性髓系白血病,接受完全匹配无关供者HCT,供者CMV血清阴性(D-),患者CMV血清阳性(R+)。马法兰、氟达拉滨和抗胸腺细胞球蛋白(ATG)预处理后,标准预防性治疗。 HCT第12天植入(D+12),D+33天血清CMV PCR阳性,570 IU/mL,但无CMV疾病表现,缬更昔洛韦450 mg,2/日诱导治疗,5天后血清CMV增至1276 IU/mL,12天 137 IU/mL,患者出现恶心呕吐,上消化道内镜显示急性胃肠道GVHD,大剂量糖皮质激素治疗,同时转为静脉更昔洛韦,2.5 mg/kg,每12小时一次,3周诱导治疗后减至维持量1.25 mg/kg/天,然后再转为缬更昔洛韦口服。 患者胃肠道GVHD复发,糖皮质激素治疗,D+78在接受缬更昔洛韦次级预防情况下血清CMV增至10320 IU/mL,重新启动更昔洛韦2.5 mg/kg诱导治疗,每12小时一次。再次消化道内镜检查,病理证实CMV肠炎。 更昔洛韦治疗2周后,血清CMV 137 IU/mL,继续更昔洛韦治疗情况下CMV再次上升,D+98达22829 IU/mL,绝对淋巴细胞计数0.47 109/L,予膦甲酸经验性治疗,CMV基因型分析只有C592G UL97 突变。膦甲酸治疗2 周,血清CMV 137 IU/mL,症状消失。 病例2 27岁女性,CMV R+,T细胞急性淋巴细胞白血病,马法兰、克拉屈滨、ATG和全身照射预处理后双脐血HCT,标准预防性治疗,D+18植入。D+30出现疱疹病毒6活化,2周膦甲酸治疗中出现急性肾损伤,电解质严重紊乱,治疗结束后上述表现缓解。 D+60,PCR分析显示血清CMV为255 IU/mL,再次膦甲酸治疗,90 mg/kg,每12 小时一次,共21天。最初血清CMV增至2370 IU/mL,11天后 137 IU/mL。膦甲酸治疗时再次急性肾功损伤,调整药物剂量。诱导治疗后维持治疗2周,然后缬更昔洛韦次级预防。 D+112患者CMV再次活化,377 IU/mL,再次膦甲酸治疗,7天时血清CMV升至38440 IU/mL,加用更昔洛韦,5 mg/kg,每12小时一次,基因型分析显示V715MUL54突变,停用膦甲酸。更昔洛韦治疗21 天后,血清CMV 137 IU/mL。 D+169,患者恶心呕吐,上消化道内镜显示胃肠道GVHD,高剂量糖皮质激素治疗。CMV再次升至475 IU/mL,重新更昔洛韦治疗,2周后血清CMV仍高达12552 IU/mL,无CMV疾病表现,绝对淋巴细胞计数0.17 109/L,基因型分析显示不但有V715M UL54 突变,还出现A594V UL97突变,膦甲酸和更昔洛韦均停用,西多福韦、来氟米特和2次CMV特异性CTL输注。 2周后CMV降至907 IU/mL,再次输注2次CMV特异性CTL,共4周静脉西多福韦治疗,5 mg/kg,每周一次,其后来氟米特维持治疗。D+253,血清CMV 137 IU/mL,继续来氟米特维持治疗,其间有几次CMV短暂回升,137-250 IU/mL,但无CMV疾病表现。 一、耐药难治CMV感染的诊断 1. 定义 抗病毒药物耐药可以是一个或多个突变所致的真正病毒耐药,也可是缺少突变的临床耐药。区分二者非常重要,因为临床耐药主要与宿主或病毒因素有关,非基因突变所致。如果2周足量抗病毒治疗,CMV病毒血症仍无改善,应考虑抗病毒药物耐药;延长抗病毒治疗期间( 6周,包括2周足量治疗)且存在风险因素时,发生CMV脏器疾病时也要考虑抗病毒药物耐药。 未接受过治疗患者,由于免疫抑制和糖皮质激素应用,病毒载量在治疗最初2周内可能会有中度增高,此时并非药物耐药,不需改变治疗;未接受过治疗的成人,最初6周发生耐药不常见,不过儿童HCT或原发性免疫缺陷病患者接受去T细胞HCT后可能出现高CMV载量;有些特定CMV疾病可能在血中检测不到病毒载量,因此病情无改善或进展时,即便病毒载量较低也应考虑耐药,因为症状可能是耐药唯一表现。 难治性CMV感染定义与抗病毒药物耐药的定义相似,但不能检测到已知的遗传性突变导致的耐药。 2. 实验室检查 2种方法诊断抗病毒药物耐药:表型减斑实验(PRA)和基因型分析。PRA认为是金标准,不过实验间和实验室间差异较大,耗费时间,已较少应用。 基因型分析可快速检测药物耐药,鉴定耐药突变,区分真正耐药还是宿主因素所致临床耐药,可直接使用血液、体液或组织标本检测。DNA测序是目前检测耐药的标准,CMV 1000 IU/mL时结果可靠。不过因为存在随机和不相关突变,结果解释较为困难,且突变 20-30%时可有假阴性,不过深度测序可克服这一缺陷,不过较为昂贵。 二、抗病毒活性和CMV耐药的遗传学机制 1. CMV基因组结构与关键蛋白 CMV属 疱疹病毒,编码164个蛋白,包括DNA聚合酶,所有获批抗CMV药物都是靶向抑制DNA聚合酶,ORF UL54编码高度保守的CMV DNA聚合酶(Pol 或pUL54);UL97 ORF 编码蛋白激酶pUL97,pUL97能控制更昔洛韦在CMV感染细胞中的磷酸化;CMV复制过程中的多个步骤均由末端酶复合物控制, UL56 ORF编码 pUL56,是末端酶复合物的构成蛋白之一。 2. 更昔洛韦、缬更昔洛韦和 UL97 更昔洛韦是核苷酸类似物,静脉应用,体内经pUL97和CMV感染细胞的激酶磷酸化后活化成为三磷酸更昔洛韦,强烈抑制CMV聚合酶,降低病毒DNA复制。缬更昔洛韦是更昔洛韦前体,口服使用转化为更昔洛韦进入循环系统,生物利用度 60%,是口服更昔洛韦10倍,二者活性与毒性相同。 CMV对更昔洛韦耐药与pUL97和pUL54改变有关, UL97有多种突变,其中 7种突变最常见,占UL97耐药突变 80%,使得IC50增加5- 15倍。此外还有一些缺失突变也导致不同程度耐药,如密码子590-607,致pUL97无法将更昔洛韦作为底物;密码子460和520突变通过影响ATP结合而影响激酶活性;C592G UL97突变导致更昔洛韦较低程度耐药(表1)。 表1 临床已证实的UL97突变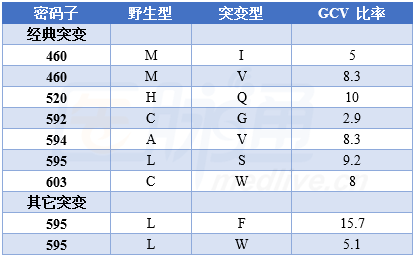 病例1中CMV耐药,有报道增加更昔洛韦剂量可克服耐药,不过Chaer教授认为该病例经验性使用膦甲酸更恰当,因为 UL97突变可使更昔洛韦耐药性增加5-15倍,不宜高剂量单药更昔洛韦治疗。虽然病例1发生肾功异常,但因患者既往曾使用过更昔洛韦,高度可能先出现 UL97 突变,因此经验性转换为磷甲酸更恰当(图1)。
病例1中CMV耐药,有报道增加更昔洛韦剂量可克服耐药,不过Chaer教授认为该病例经验性使用膦甲酸更恰当,因为 UL97突变可使更昔洛韦耐药性增加5-15倍,不宜高剂量单药更昔洛韦治疗。虽然病例1发生肾功异常,但因患者既往曾使用过更昔洛韦,高度可能先出现 UL97 突变,因此经验性转换为磷甲酸更恰当(图1)。
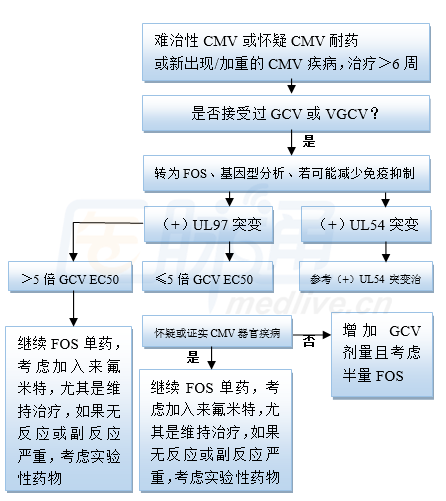 图1 MD Anderson治疗难治耐药UL97突变CMV感染流程(GCV更昔洛韦,VGCV缬更昔洛韦,FOS膦甲酸)
3. 交叉耐药:膦甲酸、西多福韦、更昔洛韦、缬更昔洛韦和UL54
膦甲酸是有机焦磷酸类似物,细胞内高水平膦甲酸能可逆性抑制pUL54。西德福韦是核酸类似物,经细胞内激酶磷酸化后,三磷酸西德福韦抑制pUL54。所有获批治疗CMV药物均以抑制pUL54作为最终靶点,UL54突变诱导所有药物交叉耐药。UL54 突变多发生于同源保守区,外切酶和聚合酶区域突变导致CMV对一个或多个抗病毒药物耐药。更昔洛韦和缬更昔洛韦受hUL97和UL54突变影响,UL97 突变多先出现, UL54突变在 UL97 突变基础上增加耐药作用。膦甲酸和西德福韦活性不依赖pUL97,不受其突变影响。
病例1的另一个治疗选择是使用西德福韦,因其磷酸化不依赖 UL97,不过HCT患者使用西德福韦经验有限,有报道有效性较为短暂,易发生耐药、增加肾功损伤。如果患者同时有UL54突变,不应使用西德福韦,因为几乎所有致更昔洛韦耐药的UL54突变也会导致西德福韦交叉耐药。此时Chaer教授采用经验性更昔洛韦-膦甲酸联合治疗或是实验性药物治疗。
病例2中V715MUL54突变导致膦甲酸耐药,可以使用更昔洛韦治疗。本文中2例患者因快速基因型分析结果而得以快速转换为正确的抗病毒治疗,是否对死亡有影响仍需进一步研究。
编译自:How I treat resistant cytomegalovirus infection in hematopoietic cell transplantation recipients.Blood 2016
图1 MD Anderson治疗难治耐药UL97突变CMV感染流程(GCV更昔洛韦,VGCV缬更昔洛韦,FOS膦甲酸)
3. 交叉耐药:膦甲酸、西多福韦、更昔洛韦、缬更昔洛韦和UL54
膦甲酸是有机焦磷酸类似物,细胞内高水平膦甲酸能可逆性抑制pUL54。西德福韦是核酸类似物,经细胞内激酶磷酸化后,三磷酸西德福韦抑制pUL54。所有获批治疗CMV药物均以抑制pUL54作为最终靶点,UL54突变诱导所有药物交叉耐药。UL54 突变多发生于同源保守区,外切酶和聚合酶区域突变导致CMV对一个或多个抗病毒药物耐药。更昔洛韦和缬更昔洛韦受hUL97和UL54突变影响,UL97 突变多先出现, UL54突变在 UL97 突变基础上增加耐药作用。膦甲酸和西德福韦活性不依赖pUL97,不受其突变影响。
病例1的另一个治疗选择是使用西德福韦,因其磷酸化不依赖 UL97,不过HCT患者使用西德福韦经验有限,有报道有效性较为短暂,易发生耐药、增加肾功损伤。如果患者同时有UL54突变,不应使用西德福韦,因为几乎所有致更昔洛韦耐药的UL54突变也会导致西德福韦交叉耐药。此时Chaer教授采用经验性更昔洛韦-膦甲酸联合治疗或是实验性药物治疗。
病例2中V715MUL54突变导致膦甲酸耐药,可以使用更昔洛韦治疗。本文中2例患者因快速基因型分析结果而得以快速转换为正确的抗病毒治疗,是否对死亡有影响仍需进一步研究。
编译自:How I treat resistant cytomegalovirus infection in hematopoietic cell transplantation recipients.Blood 2016
免疫系统功能正常个体发生巨细胞病毒(CMV)感染普遍且多无症状,但癌症患者细胞免疫功能下降时,特别是造血干细胞移植(HCT)患者罹患CMV感染时出现明显并发症。目前常用有效药物包括更昔洛韦、缬更昔洛韦、膦甲酸和西多福韦。美国Chaer教授在BLOOD杂志上以2例HCT后复发难治CMV感染为例,详细描述了CMV感染的治疗。 【病例资料】 病例1 55岁男性,急性髓系白血病,接受完全匹配无关供者HCT,供者CMV血清阴性(D-),患者CMV血清阳性(R+)。马法兰、氟达拉滨和抗胸腺细胞球蛋白(ATG)预处理后,标准预防性治疗。 HCT第12天植入(D+12),D+33天血清CMV PCR阳性,570 IU/mL,但无CMV疾病表现,缬更昔洛韦450 mg,2/日诱导治疗,5天后血清CMV增至1276 IU/mL,12天 137 IU/mL,患者出现恶心呕吐,上消化道内镜显示急性胃肠道GVHD,大剂量糖皮质激素治疗,同时转为静脉更昔洛韦,2.5 mg/kg,每12小时一次,3周诱导治疗后减至维持量1.25 mg/kg/天,然后再转为缬更昔洛韦口服。 患者胃肠道GVHD复发,糖皮质激素治疗,D+78在接受缬更昔洛韦次级预防情况下血清CMV增至10320 IU/mL,重新启动更昔洛韦2.5 mg/kg诱导治疗,每12小时一次。再次消化道内镜检查,病理证实CMV肠炎。 更昔洛韦治疗2周后,血清CMV 137 IU/mL,继续更昔洛韦治疗情况下CMV再次上升,D+98达22829 IU/mL,绝对淋巴细胞计数0.47 109/L,予膦甲酸经验性治疗,CMV基因型分析只有C592G UL97 突变。膦甲酸治疗2 周,血清CMV 137 IU/mL,症状消失。 病例2 27岁女性,CMV R+,T细胞急性淋巴细胞白血病,马法兰、克拉屈滨、ATG和全身照射预处理后双脐血HCT,标准预防性治疗,D+18植入。D+30出现疱疹病毒6活化,2周膦甲酸治疗中出现急性肾损伤,电解质严重紊乱,治疗结束后上述表现缓解。 D+60,PCR分析显示血清CMV为255 IU/mL,再次膦甲酸治疗,90 mg/kg,每12 小时一次,共21天。最初血清CMV增至2370 IU/mL,11天后 137 IU/mL。膦甲酸治疗时再次急性肾功损伤,调整药物剂量。诱导治疗后维持治疗2周,然后缬更昔洛韦次级预防。 D+112患者CMV再次活化,377 IU/mL,再次膦甲酸治疗,7天时血清CMV升至38440 IU/mL,加用更昔洛韦,5 mg/kg,每12小时一次,基因型分析显示V715MUL54突变,停用膦甲酸。更昔洛韦治疗21 天后,血清CMV 137 IU/mL。 D+169,患者恶心呕吐,上消化道内镜显示胃肠道GVHD,高剂量糖皮质激素治疗。CMV再次升至475 IU/mL,重新更昔洛韦治疗,2周后血清CMV仍高达12552 IU/mL,无CMV疾病表现,绝对淋巴细胞计数0.17 109/L,基因型分析显示不但有V715M UL54 突变,还出现A594V UL97突变,膦甲酸和更昔洛韦均停用,西多福韦、来氟米特和2次CMV特异性CTL输注。 2周后CMV降至907 IU/mL,再次输注2次CMV特异性CTL,共4周静脉西多福韦治疗,5 mg/kg,每周一次,其后来氟米特维持治疗。D+253,血清CMV 137 IU/mL,继续来氟米特维持治疗,其间有几次CMV短暂回升,137-250 IU/mL,但无CMV疾病表现。 一、耐药难治CMV感染的诊断 1. 定义 抗病毒药物耐药可以是一个或多个突变所致的真正病毒耐药,也可是缺少突变的临床耐药。区分二者非常重要,因为临床耐药主要与宿主或病毒因素有关,非基因突变所致。如果2周足量抗病毒治疗,CMV病毒血症仍无改善,应考虑抗病毒药物耐药;延长抗病毒治疗期间( 6周,包括2周足量治疗)且存在风险因素时,发生CMV脏器疾病时也要考虑抗病毒药物耐药。 未接受过治疗患者,由于免疫抑制和糖皮质激素应用,病毒载量在治疗最初2周内可能会有中度增高,此时并非药物耐药,不需改变治疗;未接受过治疗的成人,最初6周发生耐药不常见,不过儿童HCT或原发性免疫缺陷病患者接受去T细胞HCT后可能出现高CMV载量;有些特定CMV疾病可能在血中检测不到病毒载量,因此病情无改善或进展时,即便病毒载量较低也应考虑耐药,因为症状可能是耐药唯一表现。 难治性CMV感染定义与抗病毒药物耐药的定义相似,但不能检测到已知的遗传性突变导致的耐药。 2. 实验室检查 2种方法诊断抗病毒药物耐药:表型减斑实验(PRA)和基因型分析。PRA认为是金标准,不过实验间和实验室间差异较大,耗费时间,已较少应用。 基因型分析可快速检测药物耐药,鉴定耐药突变,区分真正耐药还是宿主因素所致临床耐药,可直接使用血液、体液或组织标本检测。DNA测序是目前检测耐药的标准,CMV 1000 IU/mL时结果可靠。不过因为存在随机和不相关突变,结果解释较为困难,且突变 20-30%时可有假阴性,不过深度测序可克服这一缺陷,不过较为昂贵。 二、抗病毒活性和CMV耐药的遗传学机制 1. CMV基因组结构与关键蛋白 CMV属 疱疹病毒,编码164个蛋白,包括DNA聚合酶,所有获批抗CMV药物都是靶向抑制DNA聚合酶,ORF UL54编码高度保守的CMV DNA聚合酶(Pol 或pUL54);UL97 ORF 编码蛋白激酶pUL97,pUL97能控制更昔洛韦在CMV感染细胞中的磷酸化;CMV复制过程中的多个步骤均由末端酶复合物控制, UL56 ORF编码 pUL56,是末端酶复合物的构成蛋白之一。 2. 更昔洛韦、缬更昔洛韦和 UL97 更昔洛韦是核苷酸类似物,静脉应用,体内经pUL97和CMV感染细胞的激酶磷酸化后活化成为三磷酸更昔洛韦,强烈抑制CMV聚合酶,降低病毒DNA复制。缬更昔洛韦是更昔洛韦前体,口服使用转化为更昔洛韦进入循环系统,生物利用度 60%,是口服更昔洛韦10倍,二者活性与毒性相同。 CMV对更昔洛韦耐药与pUL97和pUL54改变有关, UL97有多种突变,其中 7种突变最常见,占UL97耐药突变 80%,使得IC50增加5- 15倍。此外还有一些缺失突变也导致不同程度耐药,如密码子590-607,致pUL97无法将更昔洛韦作为底物;密码子460和520突变通过影响ATP结合而影响激酶活性;C592G UL97突变导致更昔洛韦较低程度耐药(表1)。 表1 临床已证实的UL97突变
 病例1中CMV耐药,有报道增加更昔洛韦剂量可克服耐药,不过Chaer教授认为该病例经验性使用膦甲酸更恰当,因为 UL97突变可使更昔洛韦耐药性增加5-15倍,不宜高剂量单药更昔洛韦治疗。虽然病例1发生肾功异常,但因患者既往曾使用过更昔洛韦,高度可能先出现 UL97 突变,因此经验性转换为磷甲酸更恰当(图1)。
病例1中CMV耐药,有报道增加更昔洛韦剂量可克服耐药,不过Chaer教授认为该病例经验性使用膦甲酸更恰当,因为 UL97突变可使更昔洛韦耐药性增加5-15倍,不宜高剂量单药更昔洛韦治疗。虽然病例1发生肾功异常,但因患者既往曾使用过更昔洛韦,高度可能先出现 UL97 突变,因此经验性转换为磷甲酸更恰当(图1)。
 图1 MD Anderson治疗难治耐药UL97突变CMV感染流程(GCV更昔洛韦,VGCV缬更昔洛韦,FOS膦甲酸)
3. 交叉耐药:膦甲酸、西多福韦、更昔洛韦、缬更昔洛韦和UL54
膦甲酸是有机焦磷酸类似物,细胞内高水平膦甲酸能可逆性抑制pUL54。西德福韦是核酸类似物,经细胞内激酶磷酸化后,三磷酸西德福韦抑制pUL54。所有获批治疗CMV药物均以抑制pUL54作为最终靶点,UL54突变诱导所有药物交叉耐药。UL54 突变多发生于同源保守区,外切酶和聚合酶区域突变导致CMV对一个或多个抗病毒药物耐药。更昔洛韦和缬更昔洛韦受hUL97和UL54突变影响,UL97 突变多先出现, UL54突变在 UL97 突变基础上增加耐药作用。膦甲酸和西德福韦活性不依赖pUL97,不受其突变影响。
病例1的另一个治疗选择是使用西德福韦,因其磷酸化不依赖 UL97,不过HCT患者使用西德福韦经验有限,有报道有效性较为短暂,易发生耐药、增加肾功损伤。如果患者同时有UL54突变,不应使用西德福韦,因为几乎所有致更昔洛韦耐药的UL54突变也会导致西德福韦交叉耐药。此时Chaer教授采用经验性更昔洛韦-膦甲酸联合治疗或是实验性药物治疗。
病例2中V715MUL54突变导致膦甲酸耐药,可以使用更昔洛韦治疗。本文中2例患者因快速基因型分析结果而得以快速转换为正确的抗病毒治疗,是否对死亡有影响仍需进一步研究。
编译自:How I treat resistant cytomegalovirus infection in hematopoietic cell transplantation recipients.Blood 2016
图1 MD Anderson治疗难治耐药UL97突变CMV感染流程(GCV更昔洛韦,VGCV缬更昔洛韦,FOS膦甲酸)
3. 交叉耐药:膦甲酸、西多福韦、更昔洛韦、缬更昔洛韦和UL54
膦甲酸是有机焦磷酸类似物,细胞内高水平膦甲酸能可逆性抑制pUL54。西德福韦是核酸类似物,经细胞内激酶磷酸化后,三磷酸西德福韦抑制pUL54。所有获批治疗CMV药物均以抑制pUL54作为最终靶点,UL54突变诱导所有药物交叉耐药。UL54 突变多发生于同源保守区,外切酶和聚合酶区域突变导致CMV对一个或多个抗病毒药物耐药。更昔洛韦和缬更昔洛韦受hUL97和UL54突变影响,UL97 突变多先出现, UL54突变在 UL97 突变基础上增加耐药作用。膦甲酸和西德福韦活性不依赖pUL97,不受其突变影响。
病例1的另一个治疗选择是使用西德福韦,因其磷酸化不依赖 UL97,不过HCT患者使用西德福韦经验有限,有报道有效性较为短暂,易发生耐药、增加肾功损伤。如果患者同时有UL54突变,不应使用西德福韦,因为几乎所有致更昔洛韦耐药的UL54突变也会导致西德福韦交叉耐药。此时Chaer教授采用经验性更昔洛韦-膦甲酸联合治疗或是实验性药物治疗。
病例2中V715MUL54突变导致膦甲酸耐药,可以使用更昔洛韦治疗。本文中2例患者因快速基因型分析结果而得以快速转换为正确的抗病毒治疗,是否对死亡有影响仍需进一步研究。
编译自:How I treat resistant cytomegalovirus infection in hematopoietic cell transplantation recipients.Blood 2016
- 猜你会喜欢....


